Branchen
UDI mit GS1 Standards umsetzen
Sie sind ein Hersteller von Medizinprodukten und müssen Ihre Produkte UDI-konform kennzeichnen? GS1 ist eine UDI Zuteilungsstelle und erfüllt weltweit regulatorische Anforderungen, insbesondere in der EU, den USA, China, Südkorea und Saudi-Arabien.
Was ist UDI?
Unique Device Identification (UDI) ist ein System zur Identifikation, Kennzeichnung und Registrierung von Medizinprodukten und In-vitro-Diagnostika. Ziel ist es, die Patientensicherheit durch die lückenlose Rückverfolgbarkeit von Produkten zu erhöhen.
Wichtiger Hinweis
Für Medizinprodukte der Klasse I (nicht steril, ohne Messfunktion oder nicht wiederverwendbares chirurgisches Instrument) ist in Europa bereits seit dem 26. Mai 2021 die Zuteilung der Basis UDI-DI und UDI-DI für die technische Dokumentation und die Angabe der Basis UDI-DI auf der EU-Konformitätserklärung und der technischen Dokumentation zwingend erforderlich.
UDI im QMS
Damit auch nach dem UDI-Projekt weiterhin alles funktioniert, müssen alle Beteiligten, wie auch neue Mitarbeiter, über relevante Prozesse informiert sein. Legen Sie Standardvorgehensweisen (SOPs) für die richtige Identifikation, die fehlerfreie Kennzeichnung von Ihren Medizinprodukten, das Zusammenführen aller Produktdaten und das Übermitteln dieser an Geschäftspartner und Behörden fest.
Eine genaue Anleitung für die EU-konforme Dokumentation finden Sie im MDCG Dokument 2021-19.
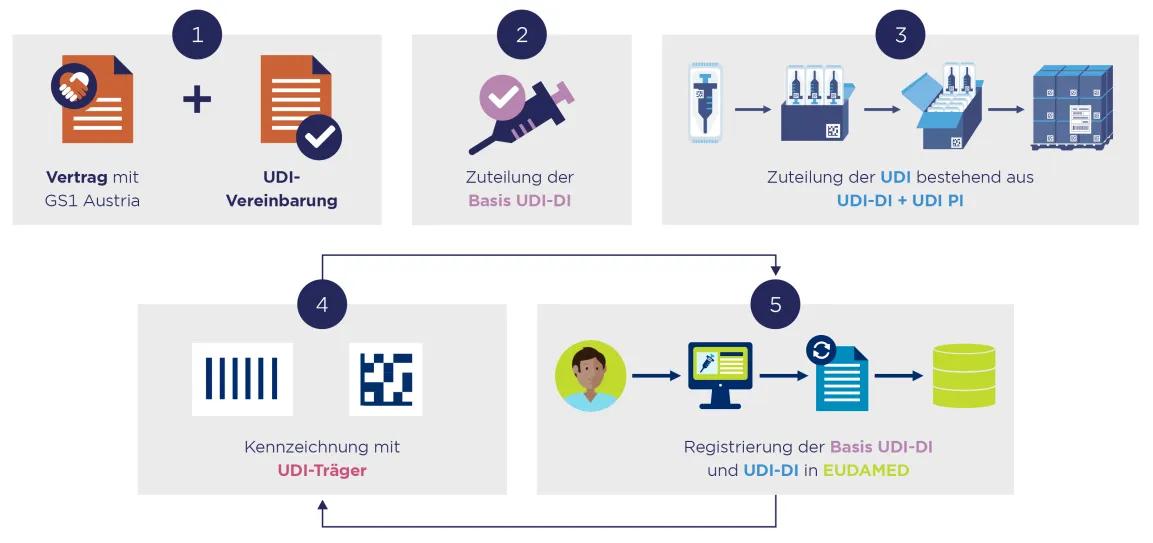
So setzen Sie UDI erfolgreich um
Vertrag mit GS1 Austria abschließen
Um zu starten, benötigen Sie einen Vertrag mit GS1 Austria.
Haben Sie bereits einen aufrechten Vertrag, fallen keine zusätzlichen Kosten für die Verwendung der GS1 Basisnummer (7- oder 9-stellig) für UDI an.
Mit dem Service Verified by GS1 können Sie jederzeit nachsehen, ob Ihr Unternehmen bereits eine GS1 Basisnummer lizensiert hat.
Es gelten die Allgemeinen Geschäftsbedingungen.
Zuteilung der Basis UDI-DI (nur in Europa)
Die Basis UDI-DI dient der Identifikation von Produktmodellen oder Produktfamilien. Diese erscheint in allen Dokumenten (v. a. Konformitätserklärung und technische Dokumentation).
Mehr dazu lesen Sie u. a. im MedTech Europe Dokument „Guidance on Basic UDI-DI Assignment“ oder in den UDI Guidance Dokumenten der MDCG.
Zur Erstellung der Basis UDI-DI verwenden Sie die Global Model Number (GMN).
Zuteilung der UDI-DI und UDI-PI
Sie teilen allen Artikeln in Ihrem Sortiment eine GTIN (= UDI-DI) zu. Nicht nur Gebrauchseinheiten, sondern auch höhere Verpackungseinheiten sollten eine GTIN (Global Trade Item Number) erhalten.
Ausgenommen sind Versandeinheiten, Sonderanfertigungen und Prüfprodukte.
Zu den wichtigsten UDI-PIs zählen die Chargen-, Seriennummer, das Verfalls- oder Herstellungsdatum und die Softwareidentifikation. GS1 bietet zur Zuordnung der UDI-PIs die GS1 Application Identifier (AI) an. Die Formate der AIs sind bei der Erstellung von UDI-PIs in jedem Fall einzuhalten.
Kennzeichnung mittels Strichcodes
Zur Kennzeichnung der Artikel und deren Verpackungsebenen verwenden Sie einen der folgenden Strichcodes:
- EAN-13 (EU: ausschließlich auf Einzelhandelsverpackungen; USA: ausschließlich Klasse I Medizinprodukte)
- GS1-128
Sie wollen sichergehen, dass der erstellte Strichcode gescannt werden kann? Dann lassen Sie ihn vom GS1 Austria Strichcodeprüfservice kontrollieren. Wir checken die Druckqualität, die Datenstruktur, den Aufbau und die Abmessungen.
Registrierung in einer UDI Datenbank
Jede Basis-UDI-DI (nur in der EU) und auch jede UDI-DI wird mit einem behördlich festgelegten Datensatz in einer UDI Datenbank eingetragen werden.
Mehr dazu lesen Sie unter „UDI Registrierung“.
UDI Registrierung
EUROPA
Wer Hersteller von Medizinprodukten (MDR/IVDR Art. 10) oder Bereitsteller von Systemen und Behandlungseinheiten (MDR Art. 22) ist, muss die Produkte UDI-konform identifizieren, kennzeichnen und in EUDAMED registrieren.
Geltungsbeginn
Die Medical Device Regulation (MDR) gilt seit dem 26. Mai 2021 und die In-Vitro Diagnostics Regulation (IVDR) seit dem 26. Mai 2022.
UDI-Träger auf der Kennzeichnung
Das Anbringen eines UDI-Trägers auf der Kennzeichnung der Produkte und auf allen höheren Verpackungsebenen erfolgt seit dem 26. Mai 2021 je nach der Risikoklasse des Produkts:
Risikoklasse | Deadline |
MD Klasse III | 26. Mai 2021 |
MD Klasse II und IVD Klasse D | 26. Mai 2023 |
MD Klasse I und IVD Klasse B & C | 26. Mai 2025 |
IVD Klasse A | 26. Mai 2027 |
USA
Seit 24. September 2013 müssen Medizinprodukte, die an den US-amerikanischen Markt geliefert werden, anhand der UDI-Richtlinie der US-amerikanischen FDA eindeutig identifiziert und gekennzeichnet werden.
Für die Hersteller bzw. „Labeler“ bedeutet das: Wollen Sie Ihre Produkte weiterhin in den amerikanischen Markt exportieren, müssen Sie die UDI-Auflagen erfüllen.
Weitere Details zu den UDI-Anforderungen der US FDA erhalten Sie über die sehr ausführliche Website der FDA oder über die Website von GS1 US. Bitte beachten Sie, dass Sie als GS1 Nutzer die Anforderungen der FDA erfüllen können. Um GS1 Nutzer zu werden, müssen Sie das GS1 Connect beantragen. Ein zusätzlicher Vertrag mit GS1 US ist grundsätzlich nicht notwendig.
Gerne unterstützt Sie auch Ihr GS1 Austria Ansprechpartner mit Rat und Tat.
Die US UDI-Timeline
Eine ausführliche Übersicht gibt es hier: Compliance Dates for UDI Requirements
Übermittlung von UDI-Daten an GUDID (Registrierung)
Alle Informationen über die Global UDI Database (GUDID) finden Sie auf der Website der FDA.
GS1 Austria bietet gemeinsam mit der Tochtergesellschaft EDITEL eine Lösung zur automatisierten Übertragung aller relevanten Daten an die GUDID an. Mehr dazu lesen Sie hier.
EUDAMED Registrierung
EUDAMED ist die Europäische Datenbank für Medizinprodukte, in der Medizinprodukte und In-Vitro-Diagnostika (IVDs) registriert werden müssen. Mit der Datenbank wird die Transparenz am Markt erhöht werden.
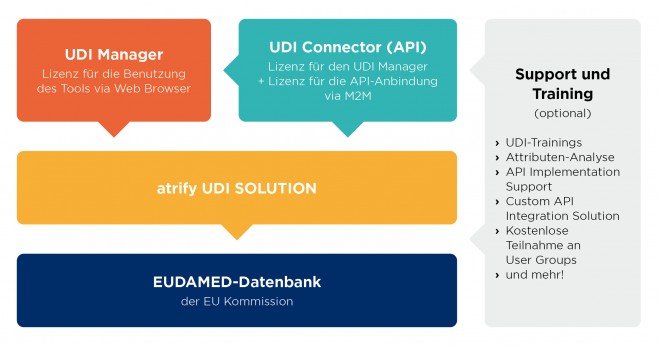
Sie haben UDI mit GS1 Austria bereits umgesetzt und stehen nun vor der Herausforderung, Ihre UDI-Daten in EUDAMED zu registrieren?
In der atrify UDI Solution, die GS1 Austria anbietet, können Sie ihre UDI Daten uploaden und verwalten.
Wir beraten und unterstützen Sie!
GS1 Austria begleitet Sie mit individueller Beratung, Schulungen und weiteren Dienstleistungen.
Neukunden Einführungsgespräch
Beim kostenlosen Einführungsgespräch werden grundsätzliche Fragen geklärt und Sie erhalten die wichtigsten Informationen zu UDI innerhalb von 60 Minuten.
Individuelle Beratung
Gerne beraten wir Sie ganz persönlich und individuell zu Ihren Projekten und Anliegen.
Schicken Sie uns Ihre Anfrage inklusive einer Telefonnummer zur Kontaktaufnahme.
Kosten: 300 € pro Stunde (exkl. MwSt.)
Sie erhalten bei online Beratungen auf den Stundensatz einen Rabatt in der Höhe von 25 %.
Individuelle Inhouse-Schulung
Halbtägig - Die Kosten für den halbtägigen Workshop (ca. 3 Stunden) betragen pauschal
890 € (exkl. MwSt.).Ganztägig - Die Kosten für den ganztägigen Workshop (ca. 6 Stunden) betragen pauschal
1.350 € (exkl. MwSt.).
Sie erhalten auf online durchgeführte Inhouse-Schulungen auf den Pauschalbetrag einen Rabatt in der Höhe von 25 %.
UDI Seminare
Wir bieten regelmäßig, in Kooperation mit en.co.tec UDI Seminare an. Informieren Sie sich jetzt über die nächsten Termine und melden Sie sich an!
Downloads & Zusatzinfos
Downloads UDI
Broschüre Sind Sie bereit für UDI?
Die Broschüre gibt einen Überblick, wer von UDI (Unique Device Identification) betroffen ist, was eindeutig identifiziert werden und welche Anforderungen erfüllt sein müssen – und zeigt auf, welche Lösungen das GS1 System hierfür bietet
Broschüre UDI Erfolgreich Umsetzen
Mit unseren Standards und Tipps erfüllen Sie die UDI-Anforderungen
Informationsblatt EUDAMED
Dieses Informationsblatt dient zur Vorbereitung der Teilnahme/Registrierung in EUDAMED von in Österreich ansässigen betroffenen Wirtschaftsakteuren. Erstellt wurde es durch die EUDAMED Task Force der AUSTROMED Arbeitsgruppe Regulatory in Kooperation mit GS1 Austria.
Sie haben Fragen zu UDI?
Wir unterstützen Sie mit unserem Know-how gerne persönlich.